Los ácidos, las bases y las sales pertenecen a un grupo de sustancias llamadas electrolitos,se caracterizan porque al disolverse en agua se disocian en iones lo que permite que sean conductores de la electricidad.
Teoria de Arrhenius
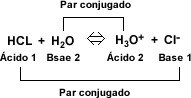
Arrhenius propuso, que los ácidos eran sustancias que al ionizarse producían iones de hidrógeno (H+). Por ejemplo el HCl al ionizarse da lugar a los iones de hidrógeno y a los iones de cloruro.
Según la misma teoría, las bases son sustancias que en solución acuosa producen iones hidróxido (OH-)
La reacción entre un ácido y una base, es una neutralización.
Esta reacción se simplifica indicando sólo la reacción iónica, donde se combinan los iones H+ del ácido con los OH- de la base para formar moléculas de agua.
- Electrolitos fuertes: son aquellos electrolitos que cuando se disuelven en el agua, se ionizan totalmente: ejemplo de estos electrolitos fuertes son HCl, NaOH, KOH
- Electrolitos débiles: son los que se ionizan en baja proporción en solución diluida.
- Ácido: es una sustancia capaz de ceder un protón.
- Base: es una sustancia capaz de aceptar un protón.
Equilibrio de ácidos y bases débiles
En las disoluciones de electrolitos fuertes, no existe el equilibrio, ya que la ionización es total. Pero para los ácidos y las bases débiles, existe equilibrio en solución acuosa. Por lo tanto existe una constante de equilibrio que recibe el nombre de constante de acidez (Ka) y una constante de basicidad (Kb).
Producto iónico del agua
La ionización del agua químicamente pura se describe de la siguiente manera: se produce un ión hidronio y un ión hidroxilo. La constante de equilibrio para la ecuación es:
Pero como la concentración del agua es constante, al multiplicar este valor constante por la constante de equilibrio (Ke), se obtiene otra constante (Kw), que recibe el nombre de producto iónico del agua.
Los experimentos han demostrado que a 25 ºC las concentraciones de H3O+ y OH- son iguales y que tienen un valor de 1 x 10-7.
El agua es una sustancia neutra gracias a que las concentraciones de iones hidronio e hidroxilo son iguales. Si se produce una variación de alguna de las concentraciones se observa un desplazamiento del equilibrio, según el principio de Le Chatelier, lo que mantiene inalterado el valor del producto iónico del agua (Kw).
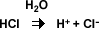
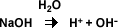
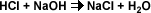
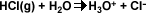
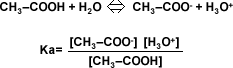

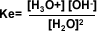
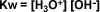
No hay comentarios:
Publicar un comentario